Münsteraner Max-Planck Forscher entschlüsseln Ursachen des Plötzlichen Herztods
iPS-Technologie bringt seltene Erkrankung in die Petrischale
Seltene Erkrankungen sind ein Sammelbegriff für erblich bedingte Leiden, die durch Defekte in einzelnen Genen hervorgerufen werden. Das Erkennen der zugrundeliegenden Mechanismen und die Entwicklung personalisierter Therapie-Möglichkeiten stellt Forscher oft vor große Herausforderungen. Unter Zuhilfenahme patientenspezifischer, reprogrammierter Stammzellen ist es Münsteraner Forschern um Dr. Boris Greber vom Max-Planck-Institut für molekulare Biomedizin nun gelungen, wichtige Einblicke in die Ursachen und die mögliche Bekämpfung einer seltenen Herzkrankheit zu erlangen, die den sogenannten plötzlichen Herztod verursacht. (PNAS, online vorab, 01.12.2014)
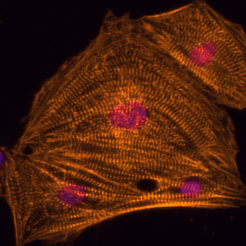
Aus humanen pluripotenten Stammzellen abgeleitete Herzmuskelzellen in der Petrischale (Immunfluoreszenzfärbung)
Herzleiden sind die Todesursache Nummer 1 in Industrieländern. Zum Teil sind diese erblich bedingt und zurückzuführen auf Defekte in einzelnen Genen, die für die Herzzellfunktion und die Erregbarkeit der Zellen essenziell sind. Da diese Krankheiten im Einzelnen jedoch selten auftreten, definitionsgemäß in weniger als einem von 2.000 Menschen, ist es für die pharmazeutische Industrie aus kommerzieller Sicht oft wenig attraktiv, spezifische Therapien für diese Seltenen Erkrankungen zu entwickeln. Eine weitere Hürde stellt im Falle genetischer Herzkrankheiten die Tatsache dar, dass das entsprechende Patientengewebe - Herzmuskelzellen - praktisch nicht zugänglich ist, um eine gegebene Krankheit detailliert zu erforschen. Eine besonders schwere Erkrankung stellt das Jervell- und Lange-Nielsen-Syndrom (JLNS) dar. Die Patienten sind sehr anfällig für lebensbedrohliche, stressabhängige Herzrhythmusstörungen, besonders bei körperlicher Anstrengung. Sie versterben gewöhnlich bereits im Kindes- oder Jugendalter.
Aus Stammzellen abgeleitete Herzmuskelzellen in der Petrischale
Ein JLNS-Patient spendete Hautzellen, aus denen die Forscher zunächst reprogrammierte, so genannte iPS-Zellen herstellten. Aus diesen leiteten sie Herzmuskelzellen ab, die sie in der Petrischale untersuchen konnten.
Forscher vom Max-Planck-Institut für molekulare Biomedizin und vom Universitätsklinikum Münster (UKM) haben nun einen anderen Weg eingeschlagen, um das Krankheitsverständnis zu beleuchten: sie entnahmen Hautzellen eines JLNS-Patienten und programmierten diese zunächst in pluripotente Stammzellen um. Die Stammzellen konnten im Anschluss vermehrt und wiederum in spontan schlagende Herzmuskelzellen umgewandelt werden. "Damit hatten wir erstmals die Gelegenheit, die patientenspezifischen Defekte in den Herzmuskelzellen eingehend im Labor zu untersuchen.", so Dr. Boris Greber, Forschungsgruppenleiter am Münsteraner Max-Planck-Institut. "Zwar sind die Herzmuskelzellen, die wir aus den Stammzellen ableiten konnten, nicht identisch mit Herzzellen des Patienten, aber sie teilen wichtige Grundeigenschaften - allem voran tragen sie den genetischen Defekt des Patienten in sich", sagt Dr. Miao Zhang, Erstautorin der Studie.
Tatsächlich verhielten sich die "kranken" Herzmuskelzellen in vielerlei Hinsicht so, wie man es von JLNS- Patienten her kennt: sie entwickelten Rhythmusstörungen, wenn sie bestimmten Stressbedingungen ausgesetzt wurden. "Das ist bemerkenswert und zeigt, welches Potenzial patientenabgeleitete Stammzellen für die medizinische Forschung haben - sowohl im Krankheitsverständnis als auch zur Prüfung von Therapiemöglichkeiten", sagt Professor Dr. Eric Schulze-Bahr vom Institut für Genetik von Herzerkrankungen des UKM, der die Patienten betreut und genetisch untersucht. Prinzipiell denkbar wäre es, den Gendefekt in den Zellen zu korrigieren und diese dem Patienten zurück zu transplantieren.
Dies erscheint jedoch bei genetischen Herzerkrankungen sehr schwierig, weil mitunter sämtliche Zellen des Herzens funktionell gestört sind. Stattdessen nutzten die Forscher die stammzellabgeleiteten Herzmuskelzellen, um mögliche Wirkstoffe zu testen, welche die überempfindliche Antwort und Störung der Zellen ausgleichen könnten. So konnten mit Hilfe eines Ionenkanalaktivators die stressinduzierten Rhythmusstörungen in den patientenspezifischen Zellen vollständig unterdrückt werden. Ionenkanäle sind porenbildende Proteine in den Zellmembranen, die elektrisch geladenen Teilchen, Ionen, das Durchqueren ermöglichen. Das im Verbund synchrone kontrahieren von Herzmuskelzellen beruht auf diesen Ionenkanälen. "Dies sind sehr vielversprechende Ergebnisse, die möglicherweise therapeutisches Potenzial für diese Erkrankung implizieren. Es wird aber nötig sein, die Effektivität der Substanz weiter zu steigern, bevor man Tests an Patienten in Erwägung ziehen könnte.", sagt Greber.
Neben den Münsteraner Forschern waren an diesem Projekt niederländische Kooperationspartner beteiligt (Dr. Milena Bellin, Prof. Dr. Christine Mummery, Leiden University Medical Centre; Dr. Arie Verkerk, Heart Failure Research Center, Amsterdam). Unter anderem wurde die Arbeit durch die Eva Luise und Horst Köhler Stiftung sowie das Bundesinstitut für Risikobewertung gefördert.
