Proteinstress beeinflusst die Gehirnentwicklung
Max-Planck-Wissenschaftler Sebastian Leidel und Danny Nedialkova erklären wichtigen Mechanismus
Während der Gehirnentwicklung müssen sich Zellen genau koordiniert teilen und differenzieren. Ein internationales Team um Laurent Nguyen (GIGA Institut der Universität Liege, Belgien) und Sebastian Leidel (Max-Planck-Institut für molekulare Biomedizin, Münster) hat einen wichtigen Schalter identifiziert, der diesen Prozess steuert. Durch die Untersuchung von Mausmutanten konnten sie zeigen, dass die Herstellung falsch gefalteter Proteine ein Signal verursacht, das die Differenzierung von Nervenzellen verändert. Als Folge werden die Mäuse mit einem kleineren Gehirn geboren. Die Arbeit zeigt, dass ein wichtiger Mechanismus, den die Gruppe von Sebastian Leidel in Hefe und Nematoden entdeckt hat, auch in Wirbeltieren wirkt. Entstanden ist diese erfolgreiche internationale Zusammenarbeit durch eine Zufallsbegegnung der Wissenschaftlerinnen Danny Nedialkova und Juliette Godin auf einer wissenschaftlichen Konferenz (Developmental Cell, online vorab 07. Dezember 2015).
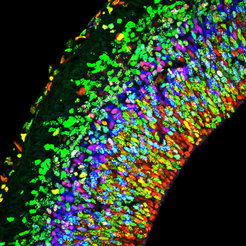
Im Gewebeschnitt sind die unterschiedlichen Zelltypen verschiedenfarbig angefärbt. Dadurch werden die Schichten der Großhirnrinde gut sichtbar.
Die Gruppe von Laurent Nguyen beschäftigt sich mit der Entwicklung des Gehirns. Wenn sich die Großhirnrinde bildet, entstehen apikale Vorläuferzellen. Im frühen Stadium der Entwicklung werden aus diesen Vorläuferzellen direkt Nervenzellen. Später in der Entwicklung wird in den Vorläuferzellen ein Schalter umgelegt. Dann bilden die Zellen einen anderen Zelltyp, sogenannte Intermediärzellen, aus denen erst im zweiten Schritt Nervenzellen entstehen. Wichtig ist, dass aus den Intermediärzellen mehr Nervenzellen entstehen als direkt aus den Vorläuferzellen. Wie dieser wichtige Umschaltprozess funktioniert, war eine offene Frage.
In einer früheren Studie hatte Danny Nedialkova, Mitarbeiterin in der Forschungsgruppe von Sebastian Leidel, gezeigt, dass verzögerte Proteinherstellung zu aggregierten Proteinen führen kann. Dies ist ein wichtiges Kennzeichen vieler neurodegenerativer Erkrankungen. Die Forschungsergebnisse wurden allerdings in Hefe und Nematoden erzielt. Daher war offen, ob ähnliche Effekte in Wirbeltieren auftreten. Viel schneller als erwartet, konnten die münsteraner Wissenschaftler nun dieses Geheimnis mit Hilfe eines Mausmodells für neurodegenerative Erkrankungen lüften.
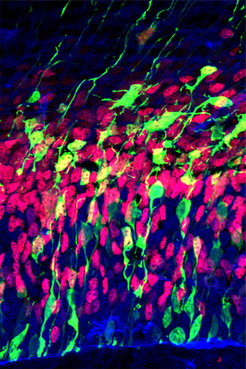
Im Gewebeschnitt können Nervenzellen bei der Entwicklung beobachtet werden. Intermediärzellen sind rot markiert. Vorläuferzellen sind blau markiert. Aktiv differenzierende Zellen sind grün markiert.
„Es war ein absoluter Zufall, dass Juliette Godin und ich bei einer wissenschaftlichen Konferenz der EMBO Stipendiaten ins Gespräch kamen“, sagt Danny Nedialkova. „Zunächst war nicht klar, dass es zwischen unseren Befunden einen Zusammenhang gab. Doch schnell wurde uns bewusst: Die Ergebnisse unserer jüngsten Studie in der Zeitschrift Cell könnten eine Erklärung für die von Laurent und Juliette untersuchte Mikrozephalie sein. Das war der Beginn unserer umfangreichen Zusammenarbeit“, sagt Nedialkova.
„Laurent Nguyen und sein Team wussten, dass Elp3 eine wichtige Rolle spielt“, sagt Nedialkova. „Dazu hatten sie ein Mausmodell etabliert, in dem Elp3 inaktiviert werden kann. Dabei beobachteten sie eine Unterentwicklung der Großhirnrinde. Doch über das Wie und Warum konnten sie nur spekulieren.“
Sebastian Leidel und Danny Nedialkova konnten hier wichtige Erklärungen liefern. Sie kannten Elp3 als Teil eines Proteinkomplexes, der tRNA, also Moleküle, die die genetische Information in eine Proteinsequenz übersetzen, modifiziert. „Ist eine tRNA fehlerhaft modifiziert, dauert es länger, um bestimmte Wörter des genetischen Codes zu lesen“, sagt Nedialkova. „In unserer Studie in Cell im Juni dieses Jahres postulierten wir, dass solche fehlerhaften oder fehlenden Modifikationen zu neurodegenerativen Erkrankungen führen können. Und tatsächlich: In den Mäusen, in denen Elp3 stillgelegt war, verringerte sich die Übersetzungsgeschwindigkeit des genetischen Codes. Zugleich fanden wir Hinweise auf falsch gefaltete Proteine”, erklärt Nedialkova.
„Interessanterweise führt das Stocken in der Proteinfabrik zu einem Signal, das die apikalen Vorläuferzellen in die direkte Differenzierung treibt. Dadurch entstehen weniger Nervenzellen als normal, und die Großhirnrinde bildet sich nicht richtig“, erklärt Leidel. „Dies ist einmal mehr ein tolles Beispiel dafür, wie wichtig Offenheit in der Wissenschaft ist! Sonst würden wir heute noch nicht verstehen, warum sich solche Mäuse nicht richtig entwickeln können.“

