Herzmuskelgewebe aus pluripotenten Stammzellen - wie das geht und wozu es zu gebrauchen ist
Forschungsbericht (importiert) 2016 - Max-Planck-Institut für molekulare Biomedizin
Klettern im Entscheidungsbaum
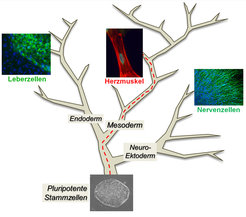
Die meisten Zellen unseres Körpers sind hochspezialisiert und nehmen, je nach ihrer Lage, nur die ihnen zugeteilten Aufgaben wahr: Nervenzellen im Gehirn brauchen wir zum Denken, Muskelzellen zur Bewegung und so weiter. Mehr als 200 unterschiedliche Zelltypen tragen wir in uns. Man kann sich diese als Spitzen eines weit verzweigten Baumes vorstellen. Abbildung 1 zeigt das in vereinfachter Form. Doch wie entsteht die Vielfalt? Die Antwort findet sich in den Anfängen der menschlichen Individualentwicklung. Pluripotente Stammzellen sind die unspezialisierten Vorläufer aller unterschiedlichen Zelltypen unseres Körpers. Sie stellen quasi den Hauptstamm des Baumes dar (Abb. 1). Durch vielfache Teilung und Differenzierung durchlaufen die Zellen bei der Embryonalentwicklung eine Reihe unterschiedlicher Zwischenstufen, bis sie schließlich einen bestimmten Endzustand annehmen - insgesamt ein Prozess von ungeheurer Komplexität.
Einmal Nervenzelle, immer Nervenzelle - so dachte man lange Zeit. Aber der Prozess ist umkehrbar! Seit einigen Jahren ist es technisch möglich, beliebige Körperzellen, zum Beispiel Bindegewebszellen der Haut oder sogar Wurzelzellen einzelner Haare, umzuprogrammieren und in den embryonalen Stammzellzustand zurückzuversetzen [1, 2]. Während sich die meisten Körperzellen als spezialisierte Zellen nicht weiter teilen können, lassen sich die so erzeugten, induziert-pluripotent genannten Stammzellen (iPS-Zellen) praktischerweise fast unbegrenzt im Labor vermehren. Dabei behalten iPS-Zellen ihre zweite definierende Eigenschaft, nämlich sich in unterschiedliche spezialisierte Körperzellen differenzieren zu können, fortlaufend bei. Ein besonderer Zustand ist das also offenbar, in dem diese Zellen vorliegen: hochgradig vermehrungsfreudig und allzeit bereit, differenzierungsmäßig „Gas zu geben“.
Dass sich menschliche pluripotente Stammzellen auch im Labor, in einer Kulturschale mit etwas Nährflüssigkeit, in eine Reihe unterschiedlicher Zelltypen differenzieren lassen, macht sie für Forscher so interessant. Denn mit diesem System lassen sich Zusammenhänge zur Entstehung des menschlichen Körpers auf zellulärer Ebene herausfinden. Ein weiteres Ziel ist es, die auf iPS-Zellen basierende Gewebezüchtung medizinisch nutzbar machen. Wenn man iPS-Zellen in einer Kulturschale mit einfacher Nährlösung, das heißt ohne Stoffe, welche ihren undifferenzierten Zustand stabilisieren, sich selbst überlässt, bildet sich tatsächlich eine Reihe spezieller Zelltypen spontan aus, zum Beispiel Leberzellen, Herzmuskelzellen oder Nervenzellen (Abb. 1). Das Problem: bei dieser Herangehensweise entstehen wilde Gemische differenzierter Zellen. Wie lassen sich die Zellen auf kontrollierte Weise durch den „Entscheidungsbaum“ navigieren, so dass man ein einzelnes, gewünschtes Zellgewebe in hoher Ausbeute erhält? Diese Frage beschäftigt das Labor für humane Stammzellpluripotenz am Max-Planck-Institut für molekulare Biomedizin.
Heute die grüne Pille, morgen die rote
Viele Jahre entwicklungsbiologischer Forschung lieferten eine Reihe von Erkenntnissen darüber, wie die Stammzelldifferenzierung in einem neu entstehenden Organismus kontrolliert abläuft. Gesteuert werden diese komplexen Prozesse durch Signalstoffe - oftmals spezialisierte Proteine, die von außen an Zellen im Embryo „andocken“. Diese Informationen werden in den Zellkern weitergeleitet. Dort führen sie zur Abschaltung stammzellspezifischer Gene und zur Anschaltung von Genen, die für den angestoßenen Differenzierungsprozesses nötig sind. Eine Reihe biotechnologischer Firmen stellen solche Signalstoffe einzeln her. Mit ihnen lässt sich untersuchen, welche Stoffe in den Zellen welche Prozesse auslösen und welche Gene dabei reguliert werden [3]. Solche Zusammenhänge aufzudecken war ein zentrales Anliegen der Forschergruppe, um zu entschlüsseln, wie aus pluripotenten Stammzellen spontan schlagendes Herzmuskelgewebe entstehen kann (Abb. 1).
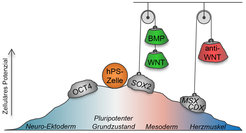
Abb. 2: Die Stammzelldifferenzierung erfordert die Beseitigung regulatorischer Barrieren. Durch die Behandlung der Zellen mit den Signalmolekülen BMP und WNT, und anschließend mit anti-WNT, werden Gene ausgeschaltet, welche die Herzmuskeldifferenzierung hemmen. Die Zellen verlieren im Laufe dieses Prozesses allmählich ihr anfangs hohes Potenzial, unterschiedlichste Zelltypen hervorbringen zu können.
Zunächst wurde durch Ausprobieren herausgefunden, in welcher Kombination und zeitlicher Abfolge die unterschiedlichen Signalfaktoren zugesetzt werden müssen. Dies lässt sich mit folgendem Bild erläutern: Man stelle sich vor, die Stammzelle sei ein Ball, der einen Hügel in gewünschter Richtung - Richtung Herzmuskel – hinunter rollen soll. Hierbei gibt es aber hintereinanderliegende Steine, die aus dem Weg zu räumen sind. Sie entsprechen unterschiedlichen regulatorischen Genen, welche den Differenzierungsprozess an zwei aufeinanderfolgenden Punkten hemmen. Es hätte nun, wie Abbildung 2 verdeutlicht, keinen Sinn, zunächst den weiter talwärts gelegenen Brocken zu beseitigen. Man sollte mit dem ersten anfangen und sich erst anschließend um Nummer zwei kümmern. In der konkreten Forschung heißt das: erst müssen den Zellen die Signalmoleküle BMP und WNT zugeführt werden, die den Austritt aus dem pluripotenten Zustand ermöglichen und die Zellen in einen Zwischenzustand überführen (Mesoderm). In einem zweiten Schritt wird die Nährlösung durch eine solche ersetzt, die einen Gegenspieler zum WNT-Signal enthielt (anti-WNT), so dass der weitere Weg in den Herzmuskelzustand frei wird (Abb. 2).
Überraschend war für die Forschergruppe die Erkenntnis, dass die Steuerung des Prozesses zum großen Teil auf der Beseitigung dieser Barrieren beruht und nur teilweise auf der Notwendigkeit, dem Ball anfangs einen ordentlichen Tritt zu versetzen [5]. Die initiale Ausschaltung des Regulatorgens SOX2 (Abb. 2) scheint dabei ein universeller Mechanismus zu sein, um die mesodermale Differenzierung zu starten – sowohl beim Menschen als auch in vielen anderen Organismen. Derart einfache Eingriffe in die Signalwege der Stammzellen können also durchaus ausreichen, um einen an sich komplizierten, mehrstufigen Prozess hin zu spezialisierten Körperzellen zu steuern [6].
Krankheitsforschung in der Kulturschale
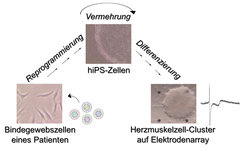
Arbeitsablauf zur Generierung von iPS-Zellen und daraus abgeleiteten Herzmuskelgewebes aus Zellproben von Patienten. Die farbigen Kügelchen stellen Gene dar, die den Prozess der Reprogrammierung bewerkstelligen.
Im Falle der Herzmuskeldifferenzierung war das Verfahren so effizient, dass nahezu sämtliche Zellen in der Kulturschale in spontan kontrahierendes Gewebe überführt wurden (Video 1) - ähnlich einem autonom schlagenden Herzen im Zuge einer Organtransplantation. Damit war eine wichtige Voraussetzung erfüllt, um das System für angewandte Zwecke zu nutzen. Die Forscher entnahmen einem Patienten mit einer erblichen Herzkrankheit, dem Jervell-Lange-Nielsen-Syndrom (JLNS), Hautzellen und reprogrammierten diese in pluripotente iPS-Zellen (Abb. 3).
Anschließend differenzierten sie die Stammzellen in patientenspezifische Herzmuskelzellen, die weiterhin den ursächlichen Gendefekt in sich trugen. Diese Zellen brachten sie auf Elektrodenchips auf, um deren elektrische Aktivität messen zu können - zu vergleichen mit der Aufzeichnung eines Elektrokardiogramms bei Herzpatienten, bei der man Elektroden auf der Körperoberfläche anbringt (Abb. 4).
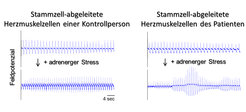
Der Vorteil dieses Verfahrens besteht darin, dass es - durch die Vermehrbarkeit der iPS-Zellen - einen unbegrenzten Zugang zu patientenspezifischem Zellmaterial bietet. Im Vergleich zu gesunden Kontrollzellen verhielten sich die Patientenzellen tatsächlich wie erhofft: das Herzmuskelgewebe mit dem Gendefekt zeigte Arrhythmien, wenn man ihm ein Adrenalin-Analogon zusetzte, während die Kontrollzellen lediglich schneller schlugen. Diese Reaktion ähnelt der erhöhten Herzschlagfrequenz in Stressituationen, wobei JLNS-Patienten lebensbedrohliche Rhythmusstörungen erleiden können (Abb. 4). An solchen patientenspezifischen Herzzellen lassen sich mögliche Medikamente testen, ohne den Patienten zu gefährden oder Tierversuche durchführen zu müssen. In der Tat fand die Forschergruppe eine Substanz, welche die Zellen vor der Auslösung von Arrhythmien unter Stress schützte [7]. Die Potenz dieses Wirkstoffes muss weiter verbessert werden, bevor die tatsächliche Anwendung bei Patienten in Frage käme, doch zeigt die Arbeit der Wissenschaftler, wie sich aus grundlagenorientierter Stammzellforschung neue Anwendungsmöglichkeiten für die Medizin ergeben.



