Computersimulationen stellen bildlich dar, wie DNA erkannt wird, um Zellen in Stammzellen umzuwandeln
Forscher des Hubrecht-Instituts (KNAW - Niederlande) und des Max-Planck-Instituts in Münster haben entdeckt, wie ein essentielles Protein bei der Umwandlung von normalen adulten humanen Zellen in Stammzellen zur Aktivierung der genomischen DNA beiträgt. Ihre Ergebnisse werden im „Biophysical Journal“ veröffentlicht.
Die Identität einer Zelle wird dadurch bestimmt, ob die DNA zu einem beliebigen Zeitpunkt „gelesen“ oder „nicht gelesen“ wird. Die Signalisierung in der Zelle, das Lesen der DNA zu starten oder zu stoppen, erfolgt durch Proteine, die Transkriptionsfaktoren genannt werden. Identitätsveränderungen geschehen während der Entwicklung auf natürliche Weise, wenn Zellen von einer unbestimmten Zelle zu einem bestimmten Zelltyp übergehen. Wie sich herausstellt, können diese Übergänge auch umgekehrt werden. Im Jahr 2012 erhielten ein britischer und ein japanischer Forscher den Nobelpreis für deren Entdeckungen, dass ausgereifte Zellen in Stammzellen zurückverwandelt werden können.
Ein umfassenderes Verständnis der molekularen Prozesse in Richtung Stammzelltherapien
Bislang ist nicht bekannt, wie die Umwandlung einer Hautzelle in eine Stammzelle auf molekularer Ebene genau abläuft. „Wenn wir solche Zellen für einzelne Patienten in Zukunft zuverlässig und effizient herstellen wollen, ist ein vollständiges Verständnis der Prozesse mit atomaren Details unerlässlich“, sagt Forschungsleiter Vlad Cojocaru vom Hubrecht-Institut. „Es wird zwar angenommen, dass solche künstlich hergestellten Zelltypen in Zukunft dazu beitragen können, Krankheiten wie Alzheimer und Parkinson zu heilen, dazu müsste der Produktionsprozess jedoch effizienter und vorhersehbarer werden“.
Der Pionier-Transkriptionsfaktor
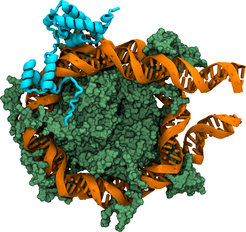
Eines der wichtigsten Proteine, die an der Stammzellbildung beteiligt sind, ist ein Transkriptionsfaktor mit der Bezeichnung Oct4. Es leitet die Genexpression bzw. die Aktivität der Proteine ein, die die adulte Zelle in eine Stammzelle „zurückverwandeln“. Diese induzierten Gene sind in den adulten Zellen inaktiv und befinden sich in dicht gepackten, geschlossenen Zuständen des Chromatins, der Struktur, die die DNA im Zellkern speichert. Oct4 trägt zur Öffnung des Chromatins bei, um die Expression der Gene zu ermöglichen. Aus diesem Grund ist Oct4 als Pionier-Transkriptionsfaktor bekannt.
Die Daten von Cojocaru und seinem Doktoranden - und Erstautor der Publikation - Jan Huertas zeigen, wie Oct4 an die DNA auf den so genannten Nukleosomen, den repetitiven DNA-Sequenzen im Chromatin, bindet. Cojocaru: „Wir haben Oct4 in verschiedenen Konfigurationen modelliert. Das Molekül besteht aus zwei Domänen, von denen in dieser Phase des Prozesses nur eine in der Lage ist, an eine bestimmte DNA-Sequenz auf dem Nukleosom zu binden. Mit unseren Simulationen haben wir herausgefunden, welche dieser Konfigurationen stabil sind und wie die Dynamik der Nukleosomen die Oct4-Bindung beeinflusst. Die Modelle wurden durch Experimente unserer Kollegin Caitlin MacCarthy und unseres Kollegen Hans Schöler in Münster validiert.“
Ein weiterer Schritt in Richtung künstlich hergestellte Faktoren
Dies ist das erste Mal, dass Computersimulationen zeigen, wie ein Pionier-Transkriptionsfaktor an Nukleosomen bindet, um das Chromatin zu öffnen und die Genexpression zu regulieren. „Unser rechnerischer Ansatz zum Erhalt der Oct4-Modelle kann auch dazu verwendet werden, andere Transkriptionsfaktoren zu screenen und herauszufinden, wie sie an Nukleosomen binden“, sagt Cojocaru.
Darüber hinaus will Cojocaru die derzeitigen Oct4-Modelle weiter verfeinern, um eine endgültige Struktur für den Oct4-Nukleosomkomplex vorzuschlagen. „Schon seit fast 15 Jahren wissen wir, dass Oct4 zusammen mit drei anderen Pionierfaktoren adulte Zellen in Stammzellen verwandelt. Wir wissen jedoch immer noch nicht, wie sie das machen. Die experimentelle Strukturbestimmung für ein solches System ist sehr kostspielig und zeitaufwendig. Unser Ziel ist es, ein endgültiges Modell für die Bindung von Oct4 an das Nukleosom zu erhalten, indem wir Computersimulationen mit verschiedenen Laborversuchen kombinieren. Wir hoffen, dass unser endgültiges Modell uns die Möglichkeit geben wird, die Pionier-Transkriptionsfaktoren für die effiziente und zuverlässige Produktion von Stammzellen und anderen Zellen zu entwickeln, die in der regenerativen Medizin benötigt werden“.
Über das Hubrecht Institute
Das Hubrecht Institute ist ein Forschungsinstitut, das sich auf die Entwicklungs- und Stammzellbiologie konzentriert. Es umfasst 23 Forschungsgruppen, die Grundlagenforschung und multidisziplinäre Forschung sowohl in gesunden Systemen als auch in Krankheitsmodellen betreiben. Das Hubrecht Institute ist ein Forschungsinstitut der Königlich Niederländischen Akademie der Wissenschaften (KNAW), das im Wissenschaftspark Utrecht liegt. Seit 2008 ist das Institut an die UMC Utrecht angegliedert, um die Umsetzung der Forschung in die Klinik voranzutreiben. Das Hubrecht Institute hat eine Partnerschaft mit dem European Molecular Biology Laboratoy (EMBL). Weitere Informationen erhalten Sie unter: www.hubrecht.eu.
Über das Max-Planck-Institut für molekulare Biomedizin
Das Max-Planck-Institut für molekulare Biomedizin in Münster widmet sich der Grundlagenforschung mit dem Ziel, die molekularen Mechanismen zu untersuchen, die den pathophysiologischen Prozessen, die zu Krankheiten führen, zugrunde liegen. In drei Abteilungen und derzeit fünf Forschungsgruppen untersuchen die international besetzten Teams mit Hilfe der Gentechnologie, der Molekularbiologie, der Elektronen- und Lasermikroskopie und rechnergestützter Ansätze verschiedene Aspekte der Zellbiologie des Endothels, der Entwicklungsbiologie und Zellerneuerung, der Entwicklung des Gefäßsystems und der Strukturbiologie. Das Max-Planck-Institut in Münster ist eines von 86 Instituten und Forschungseinrichtungen der Max-Planck-Gesellschaft.
