Nukleosomenatmung aus atomistischen Zeitschnappschüssen
Computersimulationen visualisieren auf atomarer Ebene, wie sich die DNA öffnet, während sie um Proteine gewickelt ist
Forscher des Hubrecht Institute in Utrecht (Niederlande) und des Max-Planck-Instituts für molekulare Biomedizin in Münster haben mit Hilfe von Computersimulationen im atomaren Detail gezeigt, wie sich ein kurzer DNA-Abschnitt öffnet, während er eng um die Proteine gewickelt ist, mit denen unser Genom verpackt ist. Diese Simulationen eröffnen ganz neue Einblicke in die Mechanismen, die die Genexpression regulieren. Die Ergebnisse wurden am 3. Juni 2021 in PLoS Computational Biology veröffentlicht.
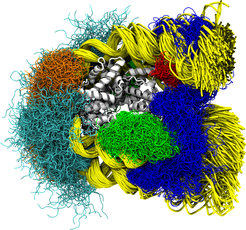
Diese Illustration wurde als Titelbild für die Juni-Ausgabe von PLoS Computational Biology ausgewählt.
Jede Zelle im Körper enthält etwa zwei Meter DNA. Um die gesamte DNA in dem kleinen Zellkern unterzubringen, wird die DNA dicht in einer Struktur gepackt, die Chromatin genannt wird. Chromatin ist eine Anordnung von identischen kleineren Strukturen, den Nukleosomen. In jedem einzelnen Nukleosom ist die DNA um acht Proteine gewickelt, Histone genannt. Das Chromatin ist im gesamten Genom nicht gleichmäßig kompakt. Die unterschiedlich dichte Verpackung ist wichtig, weil sie reguliert, welche Gene exprimiert werden und welche Proteine somit von einer Zelle produziert werden.
Übergänge von fest zu locker verpackter DNA - von geschlossenem zu offenem Chromatin - sind essentiell für Zellen, die sich in einen anderen Zelltyp verwandeln. Diese Zellkonversionen sind typisch in der Entwicklung und bei Krankheiten, werden aber auch häufig in regenerativen Therapien eingesetzt. Ein tieferer Einblick in den Ablauf solcher Übergänge kann dazu beitragen, Krankheiten besser zu verstehen und die Umwandlung von Zellen zu optimieren, um sie therapeutisch nutzen zu können.
Computergestütztes Nanoskop
Ein Schritt bei der Öffnung des Chromatins ist die Bewegung der DNA, während sie in Nukleosomen eingewickelt ist. Wie alle molekularen Strukturen in unseren Zellen sind auch die Nukleosomen recht dynamisch. Sie bewegen sich, drehen sich um die eigene Achse, „atmen“, wickeln sich aus und dann wieder ein. Diese Bewegungen mit experimentellen Methoden zu visualisieren ist oft eine große Herausforderung. Da kann der Einsatz des sogenannten „Computational Nanoscope" Abhilfe schaffen.
Mit dem Begriff „Computational Nanoscope“ bezeichnet die Wissenschaft eine Reihe von Simulationsverfahren, die mit dem Computer durchgeführt werden. Dadurch lassen sich Bewegungen von Molekülen über visualisieren. In den letzten Jahren sind die Abläufe so präzise geworden, dass Wissenschaftler angefangen haben, sie als „Computational Nanoscope" zu bezeichnen. Die Beobachtung der sich bewegenden Moleküle am Computer ist ähnlich der unter einem sehr hoch auflösenden Nanoskop.
Nukleosomenatmung
Jan Huertas und Vlad Cojocaru drehten mit Unterstützung von Hans Schöler vom Max-Planck-Institut für molekulare Biomedizin mehrere Filme, die die Bewegung der Nukleosomen in Echtzeit zeigten, wobei jeder Film eine Mikrosekunde der gesamten Lebensdauer der jeweiligen Nukleosomen abdeckte. Anhand dieser Filme beobachteten sie, wie sich die Nukleosomen mit einer typischen Bewegung öffnen und schließen, was als Nukleosomenatmung bezeichnet wird.
In ihrer neuen Arbeit, die nun in PLoS Computational Biology veröffentlicht wurde, beschreiben Huertas und Cojocaru, wodurch die Nukleosomenatmung verursacht wird. Als erstes fanden sie heraus, dass die Reihenfolge, in der die Bausteine der DNA angeordnet sind - die DNA-Sequenz - wichtig für die Nukleosomenatmung ist. Zweitens ist die Dynamik der Histonschwänze für diesen Prozess essentiell. Histonschwänze sind flexible Regionen in den Histonen, die eine Rolle bei der Regulation der Genexpression spielen. Obwohl die Rolle der Histonschwänze intensiv untersucht wird, ist bislang wenig darüber bekannt, wie sie die Bewegungen einzelner Nukleosomen beeinflussen. Mit ihren Simulationen haben Huertas und Cojocaru jetzt die Beziehung zwischen Histonschwänzen und der Atmung von Nukleosomen im atomaren Detail beschrieben.
Histonmodifikationen
„Die Atmung von Nukleosomen in Computersimulationen beobachten zu können, ist eine große Herausforderung. Dass wir diese nun visualisieren können, ist ein entscheidender Schritt hin zu einer Simulation des gesamten Spektrums der Nukleosomendynamik - von der Atmung bis zum Entpacken. Sie erlaubt uns auch zu untersuchen, wie diese Bewegungen durch Modifikationen der Histone, die in verschiedenen Zellen und Regionen unserer DNA auftreten, beeinflusst werden. Unsere Simulationen zeigten, dass zwei Histonschwänze dafür verantwortlich sind, das Nukleosom geschlossen zu halten. Nur wenn sich diese flexiblen Schwänze von bestimmten Regionen der DNA wegbewegten, konnte sich das Nukleosom öffnen“, sagt der Leiter der Studie, Vlad Cojocaru.
Jan Huertas, Erstautor der Publikation und frischgebackener PhD-Absolvent, ergänzt: „Aktives (offenes) und inaktives (geschlossenes) Chromatin enthalten unterschiedliche Modifikationen der Histonschwänze. Der nächste Schritt ist es, Simulationen mit solchen Modifikationen durchzuführen. Die atomare Auflösung der Simulationen würde es uns ermöglichen, genau zu bestimmen, wie jede Modifikation die Nukleosomen und die Chromatindynamik beeinflusst.“
Auf dem Weg zu einem besseren Verständnis der Epigenetik
Alle drei Forscher sind begeistert von dem in naher Zukunft möglichen Einsatz atomistischer Computersimulationen, der beitragen kann zum Verständnis von Genexpressionsmechanismen in der Entwicklung und bei Krankheiten. „Mit der weiteren Zunahme der weltweit verfügbaren Rechnerleistung werden wir bald in der Lage sein, Millisekunden der Lebensdauer eines Nukleosoms mit all seinen Atomen zu simulieren. Darüber hinaus werden wir dann routinemäßig mehrere Nukleosomen zu simulieren können, um die Auswirkungen verschiedener Modifikationen von Histonen auf die Genexpression zu untersuchen. Dies wird ungeahnte Einblicke in die Mechanismen ermöglichen, die die Genexpression regulieren“, sagt Cojocaru abschließend.
