Mehr als Mikroskope zeigen können
Computersimulationen machen sichtbar, wie ein wichtiges Stammzellprotein eingewickelte DNA öffnet
Ein internationales Forscherteam hat ein Schlüsselprotein für die Umwandlung von adulten Stammzellen in Zellen, die embryonalen Stammzellen ähneln, in noch nie dagewesener Detailgenauigkeit visualisiert. Durch die Kombination von Experimenten und Computersimulationen konnte das Team veranschaulichen, wie das Oct4-Protein kurze DNA-Stücke bindet und öffnet, während es um nukleare Speicherproteine (Histone) gewickelt ist, genau wie in unserem Genom. Das Team wurde von zwei Forschern des Max-Planck-Instituts für molekulare Biomedizin in Münster geleitet: Hans Schöler und Vlad Cojocaru (jetzt an der Babeş-Bolyai Universität Cluj-Napoca in Rumänien und der Universität Utrecht in den Niederlanden). Die Ergebnisse wurden am 22. September in der Zeitschrift Nucleic Acids Research veröffentlicht.
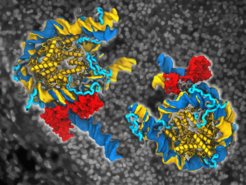
Adulte Zellen können mithilfe eines Cocktails aus nur vier Proteinen in embryonale stammzellähnliche Zellen (induzierte pluripotente Zellen, iPSC) umgewandelt werden. In den letzten Jahren hat diese Technologie der zellulären Umprogrammierung einen großen Beitrag zur Krankheitsmodellierung, Arzneimittelentwicklung und zu Zellersatztherapien geleistet. Allerdings sind viele Fragen zu den molekularen Mechanismen dieser Umwandlung noch unbeantwortet. Ein wesentlicher Schritt ist zum Beispiel die Öffnung der DNA in den umzuwandelnden Zellen. Jede unserer Zellen enthält etwa zwei Meter DNA, die in einer als Chromatin bezeichneten Struktur verpackt sind. Im Chromatin ist die DNA eng um Histone in sich wiederholenden Struktureinheiten, den so genannten Nukleosomen, gewickelt. Wie öffnen nun diese vier Proteine die DNA, wenn sie in erwachsenen Zellen exprimiert werden?
Oct4, ein bahnbrechender Regulator von pluripotenten Stammzellen
Drei der vier Proteine wurden als Pionier-Transkriptionsfaktoren beschrieben, d. h. sie binden an spezifische DNA-Sequenzen, während sie in Nukleosomen eingewickelt sind, und haben die Fähigkeit, Chromatin direkt oder indirekt zu öffnen. Unter diesen drei Faktoren sticht Oct4 hervor, da er für die Erhaltung embryonaler Stammzellen verschiedener Spezies und für die Reprogrammierung menschlicher Zellen unerlässlich ist. Oct4 wurde in den späten 80er Jahren von Hans Schöler etwa zeitgleich mit zwei anderen Labors entdeckt und ist der einzige unersetzliche Faktor in Shinya Yamanakas Nobelpreis-Cocktail zur Reprogrammierung adulter Zellen in pluripotente Zellen. Vor etwa 10 Jahren beschrieben Abdenour Soufi und Ken Zaret Regionen von verpackter DNA, die in den frühen Stadien der Reprogrammierung von Oct4 gebunden werden.
Caitlin MacCarthy, Postdoc in der Gruppe von Hans Schöler und eine der Hauptautoren der Studie, führte die Experimente im Nasslabor durch. Im Rückblick auf ihre Arbeit erklärt MacCarthy: "Die Experimente waren anspruchsvoller als wir erwartet hatten. Die Arbeit mit genomischen oder nativen Nukleosomen ist sehr technisch, da sie sehr dynamisch sind, im Gegensatz zu künstlich hergestellten Sequenzen, die stabiler sind. Dennoch konnten wir genau zeigen, wo Oct4 an sie bindet". Was passiert also, wenn Oct4 an Nukleosomen bindet?
Computergestütztes Nanoskop
Um diese Frage zu beantworten, stellte Jan Huertas, ebenfalls ein Hauptautor der Studie, die Simulationen zur Verfügung, die er während seiner Doktorarbeit am MPI in Münster durchgeführt hat. Er und Vlad Cojocaru nutzten das Computernanoskop, um zu visualisieren, wie Oct4 an Nukleosomen bindet und deren Struktur beeinflusst. Mit dem Begriff Computernanoskop bezeichnen Forscher eine Reihe von Computersimulationsmethoden, die es ihnen ermöglichen, die Bewegungen von Molekülen im Laufe der Zeit sichtbar zu machen. Die Genauigkeit dieser Methoden ist inzwischen so hoch, dass man sich vorstellen kann, die Moleküle unter einem sehr hochauflösenden Mikroskop zu beobachten. Nukleosomen sind, wie alle makromolekularen Strukturen in unseren Zellen, dynamisch. Sie bewegen sich, verdrehen sich, ‚atmen‘, wickeln sich aus und wickeln sich wieder ein. Diese Bewegungen in Experimenten sichtbar zu machen, ist oft unmöglich. Huertas erklärt: "Es ist so erstaunlich, diese großen molekularen Strukturen mit all ihren Atomen auf dem Computer zu beobachten und zu wissen, dass das, was man sieht, dem, was tatsächlich passiert, sehr nahe kommt."
Oct4 öffnet Nukleosomen
In den von ihnen erstellten Echtzeitfilmen von Oct4-Nukleosomenkomplexen, die jeweils 1 bis 3 Mikrosekunden der Lebensdauer des Komplexes zeigen, beobachteten Huertas und Cojocaru, wie Oct4 in der Lage ist, die Nukleosomen zu öffnen. Sie beschrieben die Mechanismen dieser Öffnung im atomaren Detail, indem sie die Bewegungen von freien und Oct4-gebundenen Nukleosomen verglichen. Interessanterweise hing die Öffnung von der Position der von Oct4 erkannten DNA-Sequenz auf dem Nukleosom und von der Mobilität der endständigen flexiblen Regionen der Histone, den so genannten Histonschwänzen, ab.
Zum Verständnis von Pionierfaktoren und Zellschicksalstransformationen
Die Forscher sind von den Auswirkungen ihrer Arbeit und den Zukunftsaussichten begeistert. Cojocaru, jetzt ein leitender Forscher an der Babeş-Bolyai-Universität, der auch als Senior Researcher an der Universität Utrecht und als Gastwissenschaftler am MPI in Münster tätig ist, sagt: "Wir zeigen hier zum ersten Mal im atomaren Detail nicht nur, wie Oct4 an verschiedene Nukleosomen bindet, sondern auch, wie die Bindung von Oct4 zusammen mit den Histonschwänzen die strukturelle Flexibilität dieser Nukleosomen beeinflusst." MacCarthy fügt hinzu und erklärt, warum dies so aufregend ist: "Weil die Histonschwänze, wie die Pionierfaktoren, ebenfalls wichtige Regulatoren der Genexpression sind. Während Pionierfaktoren an die DNA binden, um Chromatin zu öffnen und Gene zu aktivieren, tragen die Histonschwänze chemische Modifikationen, die die Regionen des offenen Chromatins definieren, in denen Gene exprimiert werden können." Huertas erklärt weiter: "Bislang war es ein Rätsel, wie Histonschwänze die Fähigkeit von Pionierfaktoren beeinflussen, Nukleosomen zu binden und zu öffnen. Unsere Arbeit ebnet den Weg für künftige Studien anderer Pionierfaktoren, von denen viele eine Schlüsselrolle bei zellulären Transformationen spielen, einschließlich der Umwandlung von Zellschicksalen und Krebs." Cojocaru ist überzeugt, dass "der Mechanismus, den wir hier beschreiben, eine Wissenslücke im Verständnis dessen schließt, wie Faktoren wie Oct4 Zellschicksalstransitionen einleiten. Das Verständnis dieser Mechanismen wird letztendlich Mittel zur Optimierung und Kontrolle solcher Übergänge für den erfolgreichen Einsatz in Therapien liefern. Und Computersimulationen werden das Herzstück dieser zukünftigen Entdeckungen sein".
Die Forscher würdigen, dass diese Arbeit ohne die von der Max Planck Computing and & Data Facility (www.mpcdf.mpg.de) und dem Gauss Center for Supercomputing (https://www.gauss-centre.eu) bereitgestellten Hochleistungsrechnerressourcen nicht möglich gewesen wäre.
