Regenerationswunder Plattwurm – ohne Stammzellen geht nichts
Forschungsbericht (importiert) 2013 - Max-Planck-Institut für molekulare Biomedizin
Von Regen- und Plattwürmern
Jeder kennt das Märchen vom Regenwurm: schneidet man ihn durch, hat man zwei. Von wegen! Wäre der Regenwurm jedoch ein Plattwurm, hätten beide Teile die kindlichen Attacken wohl überlebt. Mehr noch, beide Stückchen würden den verlorenen Teil in wenigen Tagen ganz einfach nachwachsen lassen, egal ob Haut, Darm oder Gehirn. Die Rede ist von Planarien [1], einer Gattung der Plattwürmer, die so flach sind, dass sie weder Lunge noch Herz brauchen, um Sauerstoff aufzunehmen und zu verteilen. So einfach und doch so talentiert? Offensichtlich. Regenerationsstudien mit diesen Tieren haben gezeigt, dass aus einer zerstückelten Planarie mehrere hundert klitzekleine Tiere entstehen können, sie sozusagen „fast unsterblich unter Messers Schneide“ sind (Dalyell, 1814). Das Erstaunliche dabei ist, dass sowohl der Bauplan als auch das Baumaterial in jedem der regenerierenden Stückchen enthalten sein muss, da aus eigener Kraft und ausschließlich mit den vorhandenen Ressourcen aus einem kleinen Schwanzstück ein gleich großer, vollständiger Wurm entsteht.
Nicht nur die Jungen können es: Pluripotenz ist auch etwas für Große
Woher kommen die Bausteine zum Wiederaufbau der zellulären Strukturen? Wissenschaftler haben bei der Suche nach einer Antwort auf diese Frage besonders eine Population von kleinen Zellen im Blick, die etwa fünf Mikrometer großen Neoblasten. Sie kommen fast überall im Körper der Planarien vor und verhalten sich wie Stammzellen: sie teilen sich, erneuern sich und können die verschiedenen Zelltypen bilden, die durch eine Amputation verloren gegangen sind (Abb. 1). Büßt die Planarie einen Teil ihres Körpers ein oder wirft sie ihren Schwanz zur Vermehrung ab, werden Neoblasten aktiviert und wandern zur Wunde hin. Dort teilen sie sich und ihre Nachkommen bilden ein sog. Blastem, in dem – unter verschiedenen außer- und innerzellulären Einflüssen – wichtige Differenzierungs- und Anordnungsprozesse stattfinden, durch die komplexe Strukturen wie das Gehirn entstehen. Eliminiert man die Neoblasten, zum Beispiel durch Bestrahlung, verliert die Planarie ihre Fähigkeit zur Regeneration und stirbt nach einigen Wochen. Dass nach Transplantation in einen bestrahlten, Neoblasten-freien Wurm, ein einziger Neoblast alle Zellarten hervorbringen kann und diesen Wurm wieder zur Regeneration befähigt, zeigt, dass zumindest einige Neoblasten pluripotent sind [2]. Pluripotenz, die Fähigkeit einer Zelle, jeden beliebigen Zelltypen eines Organismus hervorzubringen, egal ob Muskel-, Nerven-, oder Pankreaszelle, gibt es bei gesunden Säugetieren nur im frühen Embryonalstadium. Stabile Pluripotenz im adulten Tier ist also etwas Besonderes, aber nichts Unmögliches, vorausgesetzt es gibt Mechanismen, um diese Eigenschaft zu erhalten, wie es offensichtlich bei den Planarien der Fall ist.
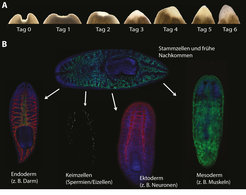
Eine In-vivo-Kulturschale für pluripotente Stammzellen
Der Erhalt der Pluripotenz ist seit Jahren ein wichtiges Thema der Stammzellforschung und wurde bisher weitgehend mit isolierten embryonalen Stammzellen erforscht. Dabei wurden wichtige Transkriptionsfaktoren entdeckt, die die Pluripotenz induzieren und erhalten können. Was könnten Planarien zur aktuellen Forschung beitragen, wenn ihre Stammzellen noch nicht einmal außerhalb des Körpers kultiviert und vermehrt werden können? Gerade darin liegt die besondere Stärke der Planarien als Modellsystem in der Stammzellforschung: die Einheit von natürlicher außerzellulärer Umgebung und pluripotenter Stammzelle. Während normalerweise kultivierte Stammzellen aus ihrer natürlichen Umgebung herausgerissen werden und somit alle wichtigen Interaktionen mit benachbarten Zellen und freibeweglichen Molekülen unterbrochen sind, können die Stammzellen in Planarien unter normalen Bedingungen, in vivo, beobachtet und manipuliert werden. Planarien sind gewissermaßen als „In-vivo-Kulturschale“ für Stammzellen attraktiv, in der nicht nur deren Mechanismen zur Pluripotenzerhaltung, sondern auch deren Regulation und Beitrag zur Regeneration untersucht werden können.
Altbekannter Wurm trifft auf hochmoderne Technologien der nächsten Generation
Obwohl Planarien schon seit Generationen als Regenerationskünstler und Forschungsobjekte bekannt sind, erleben sie erst in den letzten Jahren einen echten Boom. Besonders die Möglichkeit, Gene durch RNA-Interferenz (RNAi) spezifisch auszuschalten, und die Verfügbarkeit der Genomsequenz einer sehr gut regenerierenden Planarienspezies, Schmidtea mediterranea, haben zu diesem Interesse beigetragen. Mit der Entwicklung von modernen Sequenzierverfahren, dem „Next Generation Sequencing“, können nun auch massenweise Genexpressionsprofile erstellt werden, die darüber Aufschluss geben, welche Gene in bestimmten Zellen oder Geweben zu bestimmten Zeitpunkten aktiviert werden. Es kann also untersucht werden, welche Boten-RNAs (mRNAs) hergestellt werden, die als molekulare Schablone zur Produktion von Proteinen dienen. Hunderte solcher mRNAs werden zum Beispiel nach Amputation eines Kopfes produziert und ihre Proteine stellen somit potenzielle Regulatoren des Regenerationsprozesses dar [3; 4]. Doch hier fängt die Arbeit erst an: Inwieweit reflektiert die Präsenz einer bestimmten mRNA auch die Menge an Protein, die in der Zelle aktiv ist? Schließlich sind es hauptsächlich die Proteine, nicht ihre mRNAs, die als Enzyme, Signalmoleküle und Strukturelemente die meisten zellulären Prozesse steuern. Darüber hinaus sind ihre Herstellung mit mRNA-Schablonen und ihre Lebensdauer genau regulierte Prozesse, über die die Häufigkeit, mit der eine mRNA auftritt, nichts aussagen kann. Es ist also an der Zeit, auch für Planarien experimentelle Ansätze zu entwickeln, die über die Genexpressionsanalyse hinausgehen und den späteren regulatorischen Prozessen mehr Bedeutung beimessen.
Auch ohne Finger: der „Protein-Fingerabdruck“ eines Plattwurms
Ein wichtiger Schritt in diese Richtung ist die Entwicklung von quantifizierbaren Protein-Messmethoden. Welche Proteine kommen überhaupt in den Stammzellen der Planarien vor und in welcher Menge? Die quantitative Massenspektrometrie, mit deren Hilfe Tausende von Proteinfragmenten anhand ihrer Masse identifiziert werden können, in Kombination mit der Markierung von Proteinen, stellt einen Ansatzpunkt dar. Proteine können zum Beispiel über den Stoffwechsel markiert werden, indem ‚schwere’ Aminosäuren – Aminosäuren sind die Bausteine der Proteine – während der Proteinsynthese in das wachsende Protein eingefügt werden (Stable Isotope Labeling by Amino Acids in Cell Culture: SILAC). Die natürliche Aminosäure Lysin enthält zum Beispiel sechs Kohlenstoffatome mit je sechs Neutronen und sechs Protonen (12C6-Lysin). Ersetzt man nun dieses natürliche Lysin durch ein schweres Isotop, also ein Lysin, dessen Kohlenstoffatome sieben Neutronen und sechs Protonen enthalten (13C6-Lysin), wird das entsprechende Protein schwerer und unterscheidet sich im Massenspektrum vom ‚leichten’ Protein. So kann die Menge eines bestimmten Proteins in einer markierten und nicht-markierten Probe direkt miteinander verglichen werden.
Um die Methode SILAC auf Planarien anwenden zu können, wurde eine natürliche Eigenschaft dieser Tierchen genutzt: das Fressen von Kalbsleberpüree, ihrer Leibspeise unter Laborbedingungen. Zur Markierung mit schweren Aminosäuren wurde ihnen Leber von SILAC-Mäusen [5] vorgesetzt, die von den Planarien bereitwillig gefressen wurde, ohne Nebenwirkungen zu verursachen. Nach etwa 20 Wochen waren sämtliche Planarienproteine mit der schweren Aminosäure 13C6-Lysin markiert, also mindestens einmal ‚umgesetzt’ (Abb. 2).
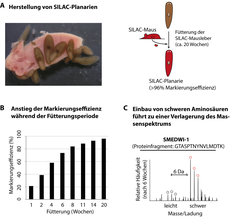
Mit Hilfe der SILAC-Methode lässt sich somit die Lebensdauer eines Proteins abschätzen und Proteinmengen lassen sich zu unterschiedlichen Zeitpunkten und in verschiedenen Geweben miteinander vergleichen. Um insbesondere die Proteine zu finden, die angereichert in den Stammzellen der Planarien vorkommen, wurde nun die Häufigkeit der Proteine in Stammzellen und in bereits spezialisierten Zellen gemessen und miteinander verglichen. Von den etwa 4000 identifizierten Proteinen war etwa ein Zehntel in den Stammzellen angereichert, diese machten also deren ‚Protein-Fingerabdruck’, das Stammzell-Proteom, aus. Unter ihnen waren zahlreiche Proteine, die in ähnlicher Form in anderen Organismen und deren Stammzellen vorkommen und mit diversen Prozessen – wie der Kontrolle der Chromatin-Struktur, der Genexpression oder des Stoffwechsels – in Verbindung gebracht worden waren. Ein erstaunlicher Anteil dieser Proteine, mehr als ein Drittel, könnten mit der Regulation der Proteinherstellung selbst zu tun haben, was andeutet, dass die Menge an mRNA tatsächlich nicht die Anzahl der dazugehörigen Proteine widerspiegelt [6].
Ein Zellkernprotein mit Potenzial
Zwischen den Stammzellen von Mäusen und Planarien gibt es viele Unterschiede, aber auch Gemeinsamkeiten. Tatsächlich wurde im SILAC-Proteom auch ein Zellkernprotein gefunden, das bisher nicht direkt mit Stammzellen in Verbindung gebracht worden war. Dieses Protein mit dem Namen Nuclear Receptor Co-Activator 5 (kurz: Ncoa5) gehört zur Familie der Proteine, die die Aktivierung von Genen steuern können und so die Befehle, die eine Zelle aus der außerzellulären Umgebung erhält, in eine Reaktion verwandeln. Eine Veränderung des Genexpressionsprofils kann gravierende Folgen für die Zelle haben und zum Beispiel aus einer pluripotenten eine spezialisierte Muskel- oder Nervenzelle machen.
Tatsächlich wurden durch das gezielte Ausschalten von Ncoa5 mit RNAi schwerwiegende Regenerationsdefekte hervorgerufen und die Planarien büßten innerhalb weniger Wochen sämtliche Stammzellen ein. Interessanterweise konnte durch Experimente in Mausembryonen die Aktivierung der Ncoa5-Expression in den pluripotenten Zellen des frühen Mausembryos nachgewiesen werden (Abb. 3) [6]. Durch welchen Mechanismus Ncoa5 zur Erhaltung des Stammzellvorkommens in Planarien beiträgt und ob sein Verwandter in der Maus auch für die Erhaltung der Pluripotenz notwendig ist, wird derzeit erforscht.
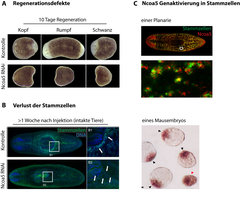
Trotz rasanten Fortschritts stecken die Technologien zur Erforschung der Planarien-Stammzellen und ihrer Mechanismen zur Selbsterhaltung noch in den Kinderschuhen. Bis wir verstehen, wie Planarien es schaffen, über Generationen ihren pluripotenten Stammzellpool zu erhalten und dabei ihre Plastizität zu wahren, wird es in der Wissenschaft um die Plattwürmer noch einige technische Innovationen zu feiern geben. Ein Beispiel ist die Entwicklung gentechnisch veränderter Tiere, mit denen es möglich sein wird, relevante Proteine gewebs- und zeitgenau zu manipulieren und den Stammzellen beim Aufbau eines regenerierenden Kopfes durch das Mikroskop zuzusehen. Trotz offensichtlich großer Unterschiede lassen aber schon jetzt kleine Gemeinsamkeiten erahnen, dass es möglich sein kann vom Plattwurm zu lernen, wie man es macht – das Regenerieren –, wenn man sie hat, die alleskönnenden Stammzellen.


