Neuer Mechanismus schützt gegen Atherosklerose
Forschungsbericht (importiert) 2022 - Max-Planck-Institut für molekulare Biomedizin
Erkrankungen des Herz-Kreislaufsystems stellen noch immer die häufigste Todesursache dar. Dabei führt der Verschluss von Blutgefäßen durch Blutgerinnsel zu oftmals tödlich verlaufendem Herzinfarkt und Schlaganfall. Ursache dafür ist die Atherosklerose, eine degenerative Veränderung der Gefäßwand, die über lange Zeitabstände zu Ablagerungen in Gefäßwänden führt, was wiederum Gefäßverengungen zur Folge hat. Vor allem durch die Aufnahme von Fetten (Lipoprotein-Partikeln) wird die Bildung sogenannter Plaques in den Gefäßwänden gefördert. Diese können die Bildung kleiner Blutgerinnsel auslösen, die zur Blockade von Kapillaren und damit zum Infarkt führen.
Es ist bekannt, dass sich atherosklerotische Plaques bevorzugt an bestimmten anatomischen Stellen von Arterien bilden, und zwar im inneren Bereich einer Gefäßkrümmung oder an Abzweigungen von Gefäßen. Diese Bereiche zeichnen sich dadurch aus, dass sie auf Grund ihrer räumlichen Struktur turbulenten und gebremsten Strömungsverhältnissen ausgesetzt sind, im Gegensatz zu langen geraden Gefäßabschnitten, in denen gleichmäßige und schnelle, laminare Strömung vorherrscht.
Ebenfalls ist bekannt, dass eine gleichmäßige, schnelle Strömung die Kontakte zwischen Endothelzellen, die die innere Oberfläche von Blutgefäßen bilden, stärkt. Dadurch wird das Eindringen von Lipoproteinpartikeln aus dem Blut in die Gefäßwand unterdrückt und die Bildung von Plaques erschwert. Im Gegensatz dazu führt schwacher turbulenter Blutfluss auf Grund von Leckagen der Endothelzellschicht zum gegenteiligen Effekt. Doch war bisher unklar, wie und warum gleichmäßige Strömung gegen diese Leckage schützt.
Der Blutstrom reguliert die Barrierefunktion der Gefäßwand
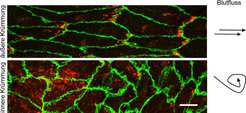
Um zu verstehen, wie sich Endothelzellen in verschiedenen Bereichen der Aorta unterscheiden, haben wir die Expression der Phosphatase VE-PTP untersucht, einem endothelialen Membranprotein, das sich auf der Zelloberfläche befindet. VE-PTP ist dafür bekannt, auf unterschiedliche Art und Weise die Integrität endothelialer Zellkontakte zu regulieren [1-3]. Wir konnten zeigen, dass sich VE-PTP in der Maus-Aorta in Bereichen laminarer gleichmäßiger Strömung umverteilt und sich am stromabwärts gelegenen Pol von Endothelzellen anreichert. Dies war deutlich weniger der Fall in Endothelzellen, die sich in Bereichen turbulenter Strömung befanden. Die polare Umverteilung von VE-PTP konnte auch in kultivierten Endothelzellen in vitro erzielt werden, sobald diese Zellen laminarer Strömung ausgesetzt wurden.
Als Folge dieser Umverteilung beobachteten wir, dass VE-PTP durch Endozytose in das Innere der Zelle aufgenommen wurde, was die Anzahl von VE-PTP Molekülen auf der Zelloberfläche deutlich verringerte. Bereits in früheren Arbeiten hatten wir entdeckt, dass VE-PTP mit dem Membranprotein Tie-2 assoziiert ist, einem Tyrosinkinase-Rezeptor, der u.a. durch Stärkung des peripheren Zytoskeletts an Zellkontakten die Barrierefunktion von Endothelzellen verbessert [2, 4].
Die Hemmung der Phosphatase-Aktivität von VE-PTP führt zur Aktivierung von Tie-2 und damit zur Stärkung der endothelialen Zellkontakte. In Übereinstimmung dazu konnten wir zeigen, dass die durch laminare Strömung ausgelöste polare Umverteilung von VE-PTP zur Aktivierung von Tie-2 auf der Zelloberfläche führte. Gleichzeitig wurde dadurch die Barrierefunktion des Endothels gestärkt, was sich sowohl in vitro in Zellkultur zeigen ließ, als auch in vivo in der Maus-Aorta, wo Leckage für Makromoleküle nur in Bereichen turbulenten Blutflusses, nicht jedoch in Bereichen mit laminarer Blutströmung zu finden war.
Die Verhinderung atherosklerotischer Plaques
Um die Relevanz dieser Befunde für die Ausbildung atherosklerotischer Plaques im Organismus zu untersuchen, setzten wir ein Mausmodell für die Atherosklerose ein. Auf Grund der oben beschriebenen Ergebnisse erwarteten wir, dass die Abwesenheit von VE-PTP dazu führen würde, dass sich weniger atherosklerotische Plaques bildeten.
Diese Annahme ließ sich in der Tat bestätigen, denn in Mäusen, in denen das Gen für VE-PTP gezielt ausgeschaltet wurde, beobachteten wir eine deutliche Reduktion der Ausbildung atherosklerotischer Plaques in der Aorta.In Übereinstimmung konnten wir auch zeigen, dass in Mäusen, die VE-PTP normal exprimieren, die Bildung atherosklerotischer Plaques wesentlich reduziert war, wenn den Mäusen während der Zeit der Hochfett-Diät ein Inhibitor von VE-PTP verabreicht wurde.
Die hier beschriebenen Ergebnisse legen den Schluss nahe, dass der gleichmäßige laminare Blutstrom durch eine Umverteilung und dadurch Entfernung von VE-PTP von der Zelloberfläche den Kinase-Rezeptor Tie-2 aktiviert, was die Stärkung der Endothelbarriere bewirkt und dadurch die Bildung atherosklerotischer Plaques verhindert. Die ermutigenden Ergebnisse mit einem pharmakologischen Antagonisten von VE-PTP sind ein Beleg dafür, dass sich VE-PTP als Zielstruktur für die Vermeidung von Atherosklerose eignen könnte [5].
![Abb. 1: Umverteilung der Phosphatase VE-PTP zum stromabwärts gelegenen Pol von Endothelzellen, VE-PTP (rot), Endothelzellkontakte (grün). Die Umverteilung findet nur in Bereichen mit gleichmäßigem, laminarem Blutstrom statt wie in der äußeren Krümmung des Aortenbogens (oben), nicht jedoch in Bereichen mit turbulentem Fluss, wie in der inneren Krümmung des Aortenbogens (unten). (Aus [5]) Abb. 1: Umverteilung der Phosphatase VE-PTP zum stromabwärts gelegenen Pol von Endothelzellen, VE-PTP (rot), Endothelzellkontakte (grün). Die Umvertei](https://www.mpg.de/19725486/original-1687519344.jpg?t=eyJ3aWR0aCI6MzQxLCJmaWxlX2V4dGVuc2lvbiI6ImpwZyIsIm9ial9pZCI6MTk3MjU0ODZ9--4e278833ead4243c51ac913bde74ff908de2f7a7)